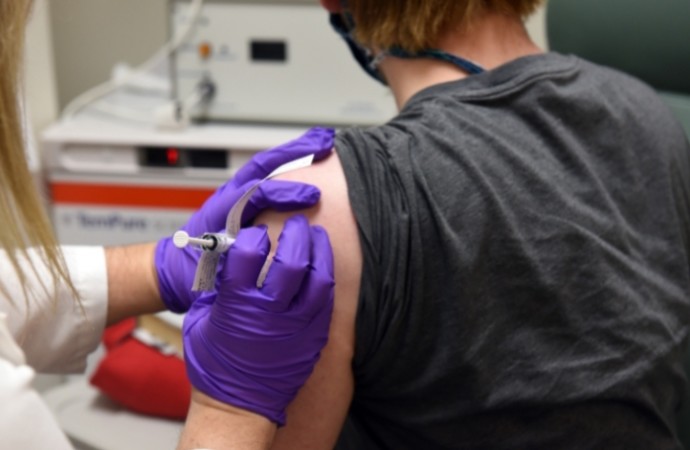
Primeros participantes fueron vacunados en la Facultad de Medicina Grossman de la Universidad de Nueva York (NYU) y la Facultad de Medicina de la Universidad de Maryland.
Pfizer y BioNTech aumentan las capacidades de manufactura para incrementar aún más la capacidad de producción en 2020/2021.
(6/May/2020 – web) Nueva York, EE.UU. y Mainz, Alemania.- Pfizer Inc. (NYSE: PFE) y BioNTech SE (Nasdaq: BNTX, “BioNTech” o “la Compañía”) anunciaron hoy que los primeros participantes fueron vacunados en los Estados Unidos en el ensayo clínico de Fase 1/2 para el programa de vacunas BNT162 para prevenir el COVID-19. El estudio es parte de un programa de desarrollo global, con pruebas en humanos ya en curso en Alemania.
El estudio de Fase 1/2 está diseñado para determinar la seguridad, la inmunogenicidad y el nivel de dosis óptimo de cuatro vacunas candidatas de ARNm evaluadas en un único estudio continuo. La porción de aumento de nivel de dosis (Etapa 1) del ensayo de Fase 1/2 en los EE.UU. incluirá hasta 360 sujetos sanos en cohortes de dos edades (18-55 y 65-85 años). Los primeros sujetos inmunizados en la Etapa 1 del estudio serán adultos sanos de 18 a 55 años de edad. Los adultos mayores solo serán inmunizados con un nivel de dosis dado de una de las vacunas candidatas una vez que las pruebas de dicha candidata y el nivel de dosis en adultos más jóvenes hayan proporcionado evidencia inicial de seguridad e inmunogenicidad. Los sitios que actualmente enrolan participantes incluyen la Facultad de Medicina de NYU y la Facultad de Medicina de la Universidad de Maryland. El Centro Médico de la Universidad de Rochester/Salud Regional de Rochester y el Centro Médico del Hospital de Niños de Cincinnati comenzarán la inscripción de participantes brevemente.
“Con nuestro único y robusto programa de estudio clínico en marcha, el cual comenzó en Europa y ahora en los EE.UU., esperamos avanzar rápidamente y en colaboración con nuestros socios en BioNTech y las autoridades reguladoras para llevar una vacuna segura y eficaz a los pacientes que más la necesitan. El corto período de menos de cuatro meses en el que hemos podido pasar de los estudios preclínicos a las pruebas en humanos es extraordinario y demuestra aún más nuestro compromiso de dedicar nuestros mejores recursos, desde el laboratorio hasta la fabricación y más allá, en la batalla contra el COVID-19”, dijo Albert Bourla, presidente y CEO de Pfizer.
El programa de desarrollo de Pfizer y BioNTech incluye cuatro vacunas candidatas, cada una de las cuales representa una combinación diferente de formato de ARNm y antígeno objetivo. El diseño novedoso del ensayo permite la evaluación de las distintas candidatas de ARNm simultáneamente para identificar la más segura y potencialmente más eficaz para evaluar en un mayor número de voluntarios, de una manera que facilite el intercambio de datos con las autoridades reguladoras en tiempo real.
“Es alentador que hayamos podido aprovechar más de una década de experiencia en el desarrollo de nuestras plataformas de ARNm, para iniciar un ensayo clínico global en múltiples regiones para nuestro programa de vacunas en un período tan corto. Nos sentimos optimistas que nuestro enfoque, basado en la ciencia, de avanzar múltiples vacunas candidatas a través de pruebas preclínicas y ahora en ensayos en humanos nos permitirá identificar potencialmente las opciones de vacunación más seguras y efectivas contra el COVID-19”, dijo el CEO y cofundador de BioNTech, Uğur Şahin.
Durante la etapa de desarrollo clínico, BioNTech proporcionará el suministro clínico de la vacuna desde sus instalaciones de fabricación de ARNm con certificación GMP en Europa.
Anticipando un exitoso programa de desarrollo clínico, Pfizer y BioNTech están trabajando para ampliar la producción para el suministro global. Pfizer planea activar su extensa red de fabricación e invertir a riesgo en un esfuerzo para producir la vacuna que sea aprobada para el COVID-19 lo más rápido posible para beneficio de los más necesitados en todo el mundo. La amplitud de este programa debería permitir la producción de millones de dosis de vacunas en 2020, aumentando a cientos de millones en 2021. Tres plantas de manufactura de Pfizer en EE. UU. (Massachusetts, Michigan y Missouri) y una en Puurs, Bélgica, han sido identificadas como centros de fabricación para la producción de la vacuna COVID-19, con plantas adicionales seleccionadas más tarde. A través de sus centros de producción de ARNm existentes en Mainz e Idar-Oberstein, Alemania, BioNTech planea aumentar su capacidad de producción para proporcionar capacidades adicionales para un suministro global de la potencial vacuna.
BioNTech y Pfizer trabajarán conjuntamente para comercializar la vacuna en todo el mundo tras la aprobación regulatoria (excluyendo China, donde BioNTech tiene una colaboración con Fosun Pharma para BNT162 tanto para el desarrollo clínico como para la comercialización).
Acerca de Pfizer: Innovaciones que cambian la vida de los pacientes
En Pfizer, utilizamos la ciencia y nuestros recursos globales para llevar a las personas terapias que extienden y mejoran significativamente sus vidas. Luchamos para establecer el estándar de calidad, seguridad y valor en el descubrimiento, desarrollo y fabricación de productos para el cuidado de la salud, incluidos medicamentos y vacunas innovadoras. Todos los días, los colegas de Pfizer trabajan en mercados desarrollados y emergentes para promover el bienestar, la prevención, los tratamientos y las curas para las enfermedades más temidas de nuestro tiempo. De acuerdo con nuestra responsabilidad como una de las principales compañías biofarmacéuticas innovadoras del mundo, colaboramos con proveedores de atención médica, gobiernos y comunidades locales para apoyar y ampliar el acceso a atención médica confiable y asequible en todo el mundo. Durante más de 150 años, hemos trabajado para hacer la diferencia para todos los que confían en nosotros. Habitualmente publicamos en nuestro sitio web www.Pfizer.com información que puede ser importante para los inversionistas. Además, para obtener más información, visítenos en www.Pfizer.com y síganos en Twitter en @Pfizer y @Pfizer News, LinkedIn, YouTube y haga clic en Me gusta en Facebook en Facebook.com/Pfizer.
Aviso de divulgación de Pfizer:
La información que contiene este comunicado es efectiva a partir del 22 de abril de 2020. Pfizer no asume obligación alguna de actualizar las declaraciones prospectivas incluidas en este comunicado como resultado de nueva información o eventos o desarrollos futuros.
Este comunicado de prensa contiene información prospectiva sobre los esfuerzos de Pfizer para combatir COVID-19, el programa de vacuna de ARNm de BioNTech, BNT162, una colaboración entre BioNTech y Pfizer para desarrollar una posible vacuna COVID-19 y el tiempo estimado en que se realizarán los ensayos clínicos, incluidos sus posibles beneficios, eso implica riesgos e incertidumbres sustanciales que podrían causar que los resultados reales difieran materialmente de aquellos expresados o implícitos en tales declaraciones. Los riesgos e incertidumbres incluyen, entre otras cosas, las incertidumbres inherentes a la investigación y el desarrollo, incluida la capacidad de cumplir con las expectativas clínicas, fechas finales, fechas de inicio y/o finalización de ensayos clínicos, fechas de presentación de normativas, fechas de aprobación regulatoria y/o fechas de lanzamiento, así como la posibilidad de nuevos datos clínicos desfavorables y análisis adicionales de datos clínicos existentes; El riesgo de que los datos de los ensayos clínicos estén sujetos a diferencias interpretaciones y evaluaciones por parte de las autoridades reguladoras; si las autoridades reguladoras estarán satisfechas con el diseño y resultados de los estudios clínicos; si y cuando alguna licencia de productos biológicos las solicitudes pueden presentarse en cualquier jurisdicción para posibles candidatos a vacunas bajo la colaboración; si las autoridades reguladoras pueden aprobar dichas solicitudes y cuándo, lo que dependerá en diferentes factores, incluida la determinación de si los beneficios del producto superan riesgos conocidos y determinación de la eficacia del producto y, si se aprueba, si existe alguna vacuna que se pueda comercializar exitosamente; decisiones de las autoridades reguladoras que afectan el etiquetado, procesos de fabricación, seguridad y/u otros asuntos que puedan afectar la disponibilidad comercial potencial de cualquiera de estas vacunas potenciales, incluido el desarrollo de productos o terapias por otras empresas; capacidad de fabricación; incertidumbres con respecto a la capacidad de obtener recomendaciones de los comités técnicos de vacunas y otras autoridades de salud pública con respecto a cualquier potencial vacuna e incertidumbres con respecto al impacto comercial de tales recomendaciones; y desarrollos competitivos.
Se puede encontrar una descripción más detallada de los riesgos e incertidumbres en el Informe Anual de Pfizer en el Formulario 10-K para el año fiscal que finalizó el 31 de diciembre de 2019, y en sus informes posteriores en el Formulario 10-Q, incluyendo las secciones del mismo tituladas «Factores de riesgo» e «Información prospectiva y factores que pueden afectar los resultados futuros», así como en sus informes posteriores en el Formulario 8-K, todos los cuales se presentan ante la Comisión de Valores y Bolsa de los EE. UU. y están disponibles en http://www.sec.gov/ y www.pfizer.com
Acerca de BioNTech
Biopharmaceutical New Technologies (BioNTech) es una compañía de inmunoterapia de última generación pionera en nuevas terapias para el cáncer y otras enfermedades graves. La compañía aprovecha una amplia gama de plataformas informáticas de descubrimiento y medicamentos terapéuticos para el rápido desarrollo de nuevos productos biofarmacéuticos. Su amplio portafolio de candidatos para productos oncológicos incluye terapias basadas en ARNm individualizadas y listas para usar, innovadoras células T con receptor de antígeno quimérico, inmunomoduladores de punto de control bi-específicos, anticuerpos contra el cáncer y moléculas pequeñas. Basado en su profunda experiencia en el desarrollo de vacunas de ARNm y en las capacidades de fabricación internas, BioNTech y sus colaboradores están desarrollando múltiples candidatos a vacunas de ARNm para diversidad de enfermedades infecciosas, junto con su amplia gama de oncología. BioNTech ha establecido un amplio conjunto de relaciones con múltiples colaboradores farmacéuticos mundiales, incluidos Eli Lilly and Company, Genmab, Sanofi, Bayer Animal Health, Genentech, miembro del Grupo Roche, Genevant, Fosun Pharma y Pfizer. Para obtener más información, visite www.BioNTech.de/
Declaración prospectiva de BioNTech
Este comunicado de prensa contiene «declaraciones prospectivas» de BioNTech en el sentido de la Ley de Reforma de Litigios de Valores Privados de 1995. Estas declaraciones prospectivas pueden incluir, entre otras: los esfuerzos de BioNTech para combatir COVID-19; los próximos pasos planeados en el proyecto de BioNTech Lightspeed; el momento para iniciar ensayos clínicos de BNT162 en Alemania; colaboraciones entre BioNTech y Pfizer, y BioNTech y Fosun Pharma, para desarrollar una potencial vacuna para el COVID-19; el momento esperado de los ensayos clínicos de BNT 162 en los Estados Unidos y China; y La capacidad de BioNTech para suministrar las cantidades de BNT162 para apoyar el desarrollo clínico. Toda declaración prospectiva en este comunicado de prensa se basa en las expectativas y opiniones actuales de BioNTech sobre eventos futuros, y está sujeta a una serie de riesgos e incertidumbres que podrían causar que los resultados reales difieran material y negativamente de los establecidos o implícitos en tales declaraciones prospectivas. Estos riesgos e incertidumbres incluyen, entre otros: competencia para crear una vacuna contra CoVID-19 y posibles dificultades. Para discutir de estos y otros riesgos e incertidumbres, vea el Informe anual de BioNTech en el Formulario 20-F presentado ante la SEC el 31 de marzo de 2020, que ha sido presentado ante la SEC y está disponible en el sitio web de la SEC en www.sec.gov. Toda la información en este comunicado de prensa es de fecha de lanzamiento, y BioNTech no se compromete a actualizar esta información a menos que lo exija la ley.
Vía Logos




































Deja un comentario
Su dirección de correo electrónico no será publicada. Los campos requeridos estan marcados con *